米乐M6官网登录正版下载|在线留言|米乐M6网页版登录入口欢迎光临 M6米乐官网登录正版下载(CHINA)·米乐M6网页版登录入口!
0519-82869996
米乐M6官网登录正版下载|在线留言|米乐M6网页版登录入口欢迎光临 M6米乐官网登录正版下载(CHINA)·米乐M6网页版登录入口!
0519-82869996
围术期低体温是指由于围术期非医疗目的导致患者核心体温低于36 ℃的一种临床现象[1],发生率为7%~90%,可导致诸多不良结局[2-3]。防治围术期低体温已成为加速康复外科(ERAS)的重要环节[4]。
自《围手术期患者低体温防治专家共识(2017)》[5]发布以来,科医师和外科医师对围术期低体温防治作出了积极努力,但2019—2021年北京部分医院统计结果表明,患者术中低体温发生率仍高达29.9%,主动保温率也仅为26.3%[6],围术期体温管理仍有待进一步加强。
2022年,国家专业质量控制中心已将全身术中体温监测率、术中主动保温率、手术期间低体温发生率、恢复室入室低体温发生率等4项指标纳入专业医疗质量控制核心指标,旨在通过将体温监测、干预和结局等纳入系统管理,持续提升围术期患者的体温管理质量。
中华医学会学分会基于当前的循证医学证据及五年来国内外在围术期低体温防治领域取得的重要进展,组织我国学领域相关专家,对第一版共识更新修订后形成《围术期患者低体温防治专家共识(2023版)》,以强化手术患者的体温规范化管理,减少术中和术后低体温相关并发症发生率,优化患者术后转归。
本共识由国家专业质量控制中心发起,工作组成员由全国质控专家和学科专家组成。2022年5月16日启动共识制订工作,2023年4月14日完成定稿。
本共识参考了相关指南5篇,系统评价8篇,纳入其他相关高质量临床试验、队列研究、病例-对照研究30余篇。由专家组共同讨论,提出相应章节的核心临床问题并撰写提纲,提交工作组讨论通过。于2022年11月11日完成初稿,采用德尔菲法,经过2轮专家讨论和沟通,最终形成了15条推荐意见[7]。
患者围术期发生低体温的危险因素很多,主要包括患者因素、手术因素、因素(包括药物因素)、环境因素以及是否干预等[2-3,8-9](表1)。

在多重因素作用下,患者发生低体温的概率明显增加。目前尚无强有力的证据表明任何单一因素会增加患者围术期低体温的发生率。
围术期患者因素、手术因素、因素和环境因素等以及是否采取干预措施是复合形成低体温的影响因素。投票赞成率:100%(35/35)。
体温调节依赖温度感受器、中枢体温调节和传出效应[10]。全身后大多数患者处于肌肉松弛状态,丧失了体温的生理性调节。因此体外温度管理是维持体温的重要途径。
Sessler[11]阐述了后体温变化的主要过程:包括热量再分布期,外周血管的扩张,中枢体温调节的抑制,造成最初的体温丢失,体温下降持续时间约1 h,之后由于热辐射、对流、传导和蒸发等原因,体温呈缓慢线 h;当持续的低体温激发了内源性血管收缩机制后,散热和产热趋于平衡而达到平台期。
椎管内和神经阻滞同样可影响体温调节系统[12],主要原因包括:热量再分布、中枢体温调节功能减弱、自主体温调节防御神经传导受阻。椎管内可使阻滞区域血管扩张,热量丢失增加,降低机体血管收缩和寒战阈值约0.5 ℃,提高出汗阈值约0.3℃,同时阻滞区域的冷感觉信号传入受阻,低体温调节的反应温度降低[10]。
椎管内复合全身时,由于二者均可降低触发血管收缩的阈值,因此复合较单纯全身更晚出现血管收缩,同时由于全身会抑制单纯椎管内时机体为增加产热而诱发的寒战反应,因此复合时核心体温会持续降低而不会出现单纯全身时的平台期[13]。
既往低体温与不良结局的关系主要局限于一些样本量较小的临床研究中。围术期低体温可导致心血管不良事件(如室性心律失常、心肌缺血、心肌梗死等)、外科手术部位感染、凝血/纤溶功能障碍、输血需求增加、药物效能和代谢改变、患者术后苏醒时间延长和寒战等不适症状增加等(表2),而出现上述情况的患者核心体温为34.5~35.5 ℃。低体温导致手术部位感染(主要为浅表感染)发生率增高3倍,心脏不良事件(主要是室性心律失常)发生率增高2倍,保温可降低36%的临床输血率[17-18]。
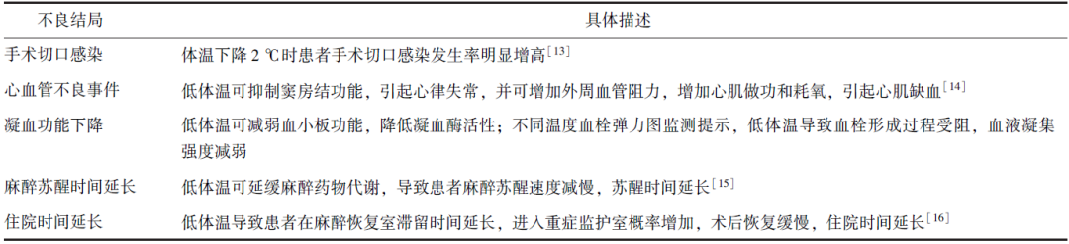
2022年,Lancet 发表了一项我国实施的大样本随机对照临床试验,共纳入5013例患者,探讨围术期体温控制在35.5 ℃(常规体温管理)或37.0 ℃(积极保温)对术后心血管不良事件(非心脏手术后心肌损伤、非致死性心脏骤停、症状性心肌缺血)和术后30 d内全因死亡率的影响,结果表明,非心脏大手术患者术中核心体温应维持于35.5~37.0 ℃,尚无证据表明任何实质性结局指标间具有统计学差异[19]。
围术期核心体温低于35.5 ℃可能与心血管不良事件、手术部位感染等不良结局相关。投票赞成率:97.1%(34/35)。
围术期患者体温监测主要为核心体温,而外周组织温度比核心体温低2~4 ℃。临床患者体温监测的部位和技术方法对于发现和防治低体温十分重要。本专家共识明确了患者体温监测的时机、频率和常用监测方法(表3)。
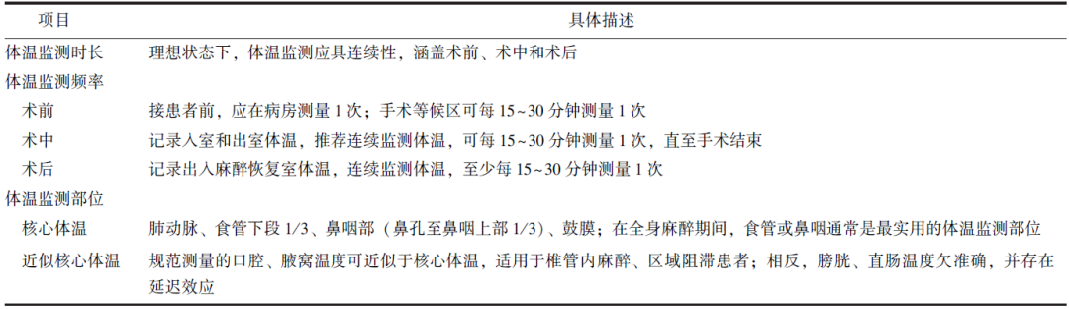
手术患者的体温监测应具有动态连续性,涵盖整个围术期,包括术前、术中和术后恢复期。围术期患者的体温监测部位和方法应尽可能与进入手术室前保持一致。术中持续进行每隔15~30 min监测1次体温,且术后恢复室内仍需进行体温监测,这不仅有助于评估术中体温保护措施的效果,还可为后续治疗提供参考[18]。
核心体温测量准确性由高至低的部位为血液(肺动脉、颈内静脉、股动脉等)、左心房相邻的食管下段1/3、鼻咽部、膀胱、直肠、口腔、鼓膜、颞动脉等[10]。在全身期间[19],食管或鼻咽通常是最实用温度监测部位,正确放置食管温度探头对于获得准确的体温数据至关重要,探头尖端的目标位置是食管的下1/3或鼻孔下10~20 cm[20-21]。直肠或膀胱的温度可反映核心体温的快速变化,适用于评估心肺转流期间外周复温的充分性(盆腔手术除外)。
新型体温监测方法(如电子体温计和红外线体温计等)具有快速、精确、舒适的优势,已逐渐取代传统的水银体温计。新型体温监测方法的精确性取决于测量部位,可实现连续监测和数据联网传输,使得围术期体温监测更实时、准确[22]。
手术患者的体温监测应具有动态连续性,涵盖整个围术期,包括术前、术中和术后恢复期;术中需应用准确度高、成本低、创伤小且能够准确反映患者核心体温的体温测量方法与部位。投票赞成率:100%(35/35)。
目前根据既往研究和临床指南,术中维持患者核心体温目标依旧定义为不低于36 ℃[16]。围术期低体温防治的具体措施主要包括[23]:(1)物理保温措施,主要分为被动保温、主动保温和增加环境温度;(2)药物干预措施。
被动保温促进热量滞留,应贯穿于整个围术期,包括人工鼻、棉毯、手术单、反光毯和隔热毯等隔热措施[24-26]。被动保温可减少30%的热量损失,其保温效果与覆盖物的材料、面积及覆盖层数相关。
(1)充气加温(FAW)设备,属于对流加热,是目前临床广泛使用的主动加温方法之一[24-26],适用于及新生儿、婴幼儿、肥胖患者等特殊人群的保温。加热后通过空气对流或接触传导使机体加温,减少热量丢失,从而维持患者核心体温处于正常范围,不增加切口感染率,较被动保温(棉被、棉毯)可更有效预防围术期体温降低,加速低体温患者复温。其保温效果与手术体位、保温部位(上腹部、下腹部、全身)、设定温度范围等有关[27]。
(2)静脉输液加温设备,包含各类隔热静脉输液管道、水浴加温系统、金属板热交换器、对流加温系统等低流速或高流速加温设备。超过1000 mL的液体以及冷藏血制品建议采用静脉输液加温设备加温至37 ℃以上再输注[28],但血制品加温不应超过43 ℃,且不宜采用水浴和微波加温方法[29]。
(3)传导加热系统,包含传导型电热毯、循环水加热系统、碳纤维电阻加温系统。荟萃分析显示,FAW设备对椎管内患者的保温效果优于传导型电热毯[30-31]。随机对照研究结果提示,循环水加热系统对于不同腹部手术患者的术中保温效果与FAW设备类似,联合FAW设备时保温效果更佳[31-32]。一项前瞻性临床试验证实,与被动保温相比,碳纤维电阻加温系统更能有效预防围术期低体温的发生[33]。
(4)其他保温措施,包括温热腔镜冲洗液或CO2气腹气体加温等[34-36],均可有效减少术中热量丢失。
被动保温措施应贯穿整个围术期,主动保温措施优于被动保温措施,复合保温方法更利于维持患者围术期体温稳定,从而有效预防低体温的发生。当患者体温<36 ℃时应开始主动保温,主动保温方式首选充气加温,充气加温效果与手术体位、温度设定和加温部位相关。投票赞成率:100%(35/35)。
热辐射热量的丢失主要取决于患者皮肤与环境的温度差。经过再分布后,环境温度对保温患者核心体温的影响很小。对主动加温患者,环境温度可设置为手术室团队舒适温度[37]。国内外普遍推荐术中手术室温度不低于21 ℃[38],实施儿科手术的手术室温度不低于23 ℃[39-40]。将上述主动保温的措施组合实施即为复合保温。现有研究表明,复合保温比单一化的主动保温更加有效[41]。
对主动加温患者,环境温度可设置为手术室团队舒适温度。推荐术中手术室温度不低于21 ℃,实施儿科手术的手术室温度不低于23 ℃。投票赞成率:97.1%(34/35)。
药物干预的目的主要是减少热量再分布(如去氧肾上腺素)[42]和增加代谢产热(如果糖、氨基酸)[43-44]。
依据围术期患者低体温评估和防治具体操作流程(图1),在术前、术中和术后3个阶段采取积极的体温保护措施,可降低患者低体温及后续并发症的发生率[1-2,4-5]。
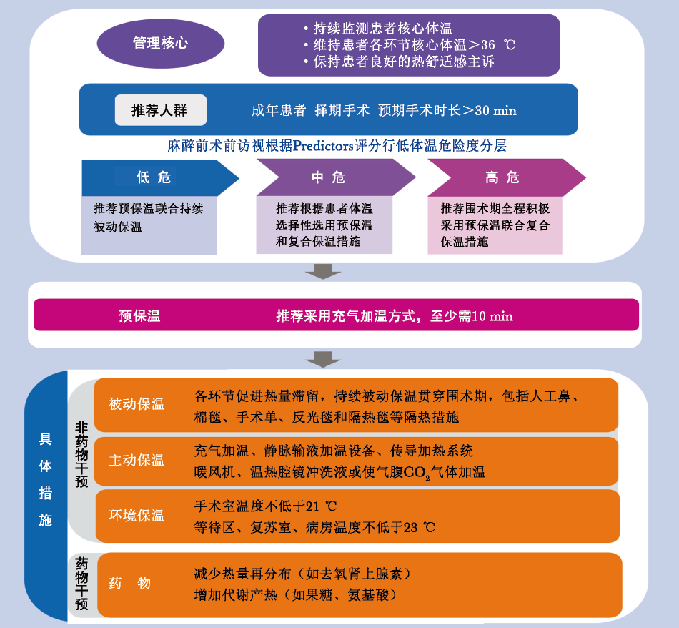
术前指患者接受前1 h,此时患者通常被转运至手术室或患者等候区。术前暴露于寒冷的环境,几乎所有患者均伴有外周血管收缩和外周组织冷感。即使患者术前体温正常,但由于术中热量再分布和体内热量短时间快速流失,术后体温仍很难迅速纠正,因此需术前有效评估、及时给予预保温措施以达到预防低体温发生的目的。
良好的围术期体温保护措施依赖于科医师术前对患者低体温风险分级的评估,综合考虑临床效益和潜在风险等因素(包括患者因素、因素、手术因素和是否干预等),从而对患者实施个体化围术期体温管理措施。
2017年一项全国横断面研究中,纳入患者体质量指数(BMI)、术前基础体温、手术规模、时间等危险因素构建了患者低体温风险预测模型,采用围术期低体温风险概率评分表(又称Predictors评分)以获得患者围术期发生低体温的风险值[45],在此评分基础上研发出围术期低体温风险预测AP。